La etapa de elongación, segunda fase del proceso de síntesis de proteínas, require proteínas específicas que no son ribosomas como las FE y EEFs. El alargamiento de polipéptidos se produce de una forma cíclica tal que al final de un ciclo completo de adición de aminoácidos el sitio A estará vacío y preparado para aceptar el aminoacil-ARNt entrante dictado por el siguiente codón del ARNm.
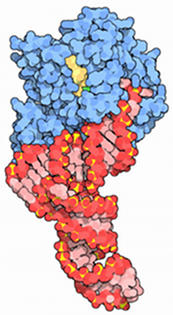
Esto significa que no sólo los aminoácido entrantes deben adjuntarse a la cadena peptídica, sino que el ribosoma debe pasar el ARNm al siguiente codón. Cada aminoacil-ARNt entrante es llevada al ribosoma por un EEF-1α-GTP complejo.
Cuando el ARNt correcto es depositado en el sitio A del GTP es hidrolizado y el EEF-1α-GDP complejo se disocia. Para eventos adicionales de translocación, el GDP debe intercambiarse por el GTP. Esto se lleva a cabo por EEF-1βγ de manera similar a como se produce el intercambio de GTP con el FEI-2 catalizada por EIF-2B.
El péptido unido al ARNt en el sitio P se transfiere al grupo amino en la aminoacil-ARNt en el sitio A. Esta reacción es catalizada por la peptidiltranserasa. Este proceso se denomina transpeptidación. El péptido alargado, ahora reside en un ARNt en el sitio A. El sitio A tiene que quedar libre para aceptar el siguiente aminoacil-ARNt. El proceso de mover la peptidil-ARNt del sitio A al sitio P se denomina, la translocación.
La translocación es catalizada por el gen EEF-2, junto a la hidrólisis de GTP. En el proceso de la translocación del ribosoma se desplaza a lo largo del ARNm de manera que el siguiente codón del ARNm se coloque el sitio A. Tras la translocación, el gen EEF libera el ribosoma y el ciclo puede comenzar de nuevo.
La capacidad del gen EEF-2 para llevar a cabo la translocación está regulada por el estado de fosforilación de la enzima. Cuando se fosforila la enzima se inhibe. La fosforilación del gen EEF-2 es catalizada por la enzima quinasa eEF2 (EEF2K). La regulación de la actividad de la encima EEF2K está normalmente bajo el control de la insulina y los flujos de Ca2+. Los efectos provocados por el Ca2+ son el resultado de la interacción de la calmodulina con la enzima EEF2K. La activación de la enzima EEF2K en el músculo esquelético por el Ca2+ es importante para reducir el consumo de ATP en el proceso de síntesis de proteínas durante los períodos de ejercicio, lo que llevará a la liberación del Ca2+ almacenado. La encima EEF2K también se regula por la fosforilación y una de las quinasas que fosforila la enzima está regulada por la proteína quinasa MTOR. Además, la proteína quinasa maestra de reglamentación metabólica, la AMP-activada proteína quinasa (AMPK) se fosforila y activa la enzima EEF2K que conduce a la inhibición del gen EEF-2.
- Fase anterior de la síntesis de proteínas: fase de iniciación de la síntesis de proteínas.
- Siguiente fase de la síntesis de proteínas: fase de terminación de la síntesis de proteínas.
Artículos relacionados con Elongación en la síntesis de proteínas
 |  |  |
| Iniciación de la síntesis de proteínas | ¿Cuál es la mejor proteína? | Proteína con posible efecto anticancerígeno |